Гипергомоцистеинемия - патологическое состояние, своевременная диагностика которого в подавляющем большинстве случаев позволяет назначить простое, дешевое, эффективное и безопасное лечение, в десятки раз снижающее риск многих жизненно опасных заболеваний и осложнений.
Гомоцистеин - продукт превращения метионина, одной из восьми незаменимых аминокислот. Из гомоцистеина в дальнейшем может образовываться другая аминокислота, цистеин, не входящая в число незаменимых аминокислот. Избыток гомоцистеина, накапливающегося в организме, может обратно превращаться в метионин. Кофакторами ферментов метаболических путей метионина в организме выступают витамины, самыми важными из которых являются фолиевая кислота, пиридоксин (B6), цианокобаламин (B12) и рибофлавин (B1).
Гомоцистеин не является структурным элементом белков, а потому не поступает в организм с пищей. В физиологических условиях единственным источником гомоцистеина в организме является превращение метионина.
Гомоцистеин обладает выраженным токсическим действием на клетку. Для защиты клетки от повреждающего действия гомоцистеина существуют специальные механизмы выведения его из клетки в кровь. В случае появления избытка гомоцистеина в организме он накапливается в крови, и основным местом повреждающего действия этого вещества становится внутренняя поверхность сосудов. Гипергомоцистеинемия приводит к повреждению и активации эндотелиальных клеток (клеток выстилки кровеносных сосудов), что значительно повышает риск развития тромбозов. Высокие уровни гомоцистеина вызывают «окислительный стресс», усиливают агрегацию тромбоцитов и вызывают активацию коагуляционного каскада, ведут к нарушению эндотелийзависимой вазодилатации и стимуляции пролиферации гладкомышечных клеток. Таким образом, гипергомоцистеинемия оказывает неблагоприятное влияние на механизмы регуляции сосудистого тонуса, обмен липидов и коагуляционный каскад, тем самым способствуя развитию разнообразных заболеваний сосудов.
Еще в 1969 г. K.McCully впервые, наблюдая детей с высоким (более 100 мкмоль/л) уровнем гомоцистеина крови, отметил, что у них рано возникают тяжелые формы поражения артерий. Исходя из этого, было сделано предположение о том, что высокий уровень гомоцистеинемии является фактором риска развития как атеросклеротического, так и тромбогенного поражения сосудов.
Причины повышения уровня гомоцистеина в крови
Самыми частыми причинами повышения уровня гомоцистеина являются витаминодефицитные состояния - недостаток фолиевой кислоты и витаминов B6, B12 и B1. Одной из главных причин витаминодефицитных состояний являются заболевания желудочно-кишечного тракта, соопровождающиеся нарушением всасывания витаминов (синдром мальабсорбции).
Одним из факторов является повышенное поступление метионина с пищей. Поэтому широко практикуемое назначение метионина в таблетках, в особенности беременным, следует проводить с осторожностью, строго по показаниям, учитывая факторы, могущие приводить к гипергомоцистеинемии, при необходимости - под контролем уровня гомоцистеина.
Потребление больших количеств кофе является одним из факторов, способствующих повышению уровня гомоцистеина в крови. У лиц, выпивающих более 6 чашек кофе в день, уровень гомоцистеина на 2-3 мкмоль/л выше, чем у не пьющих кофе. Повышенную склонность к гипергомоцистеинемиии имеют курящие. Потребление небольших количеств алкоголя может снижать уровень гомоцистеина, а большие количества спиртного способствуют росту гомоцистеина в крови. Уровень гомоцистеина часто повышается при сидячем образе жизни. Умеренные физические нагрузки способствуют снижению уровня гомоцистеина при гипергомоцистеинемии.
На уровень гомоцистеина влияет прием целого ряда лекарств (метотрексат, противосудорожные препараты, закись азота, метформин, антагонисты H2-рецепторов, эуфиллин). Неблагоприятное влияние может оказывать прием гормональных контрацептивов, однако эти данные подтверждают не все исследователи. Повышению уровня гомоцистеина способствуют некоторые сопутствующие заболевания (почечная недостаточность, заболевания щитовидной железы, сахарный диабет, псориаз и лейкозы).
Важная причина гипергомоцистеинемии - наследственные аномалии ферментов, участвующих в метаболизме метионина.
Для превращения избытка гомоцистеина в метионин нужны высокие концентрации активной формы фолиевой кислоты (5-метилтетрагидрофолата). Основным ферментом, обеспечивающим превращение фолиевой кислоты в ее активную форму, является метилентетрагидрофолат-редуктаза (МТГФР). Гомозиготная мутация гена (встречающаяся в разных популяциях у 4-14% населения) снижает активность фермента на 50%, в результате возникает стойкая умеренная гипергомоцистеинемия. Еще один часто встречающийся генетический дефект, ведущий к гипергомоцистеинемии - мутация гена цистатионин--синтазы. Гомозиготная мутация, при которой уровень гомоцистеина может достигать 400 мкмоль/л, встречается редко и приводит к тяжелому поражению сосудов в молодом возрасте и ранней смерти пациентов от атеросклероза и тромботических осложнений. Уровень гомоцистеина у гетерозиготных носителей мутантного гена, которых значительно больше, превышает норму в 2-4 раза.
Заболевания, связанные с гипергомоцистеинемией
Сердечно-сосудистые заболевания
До настоящего времени патология сердечно-сосудистой системы остается основной причиной заболеваемости и смертности среди населения во всем мире. В связи с этим продолжается поиск новых факторов риска, идентификация которых позволила бы влиять на уровень смертности от этих заболеваний.
Гомоцистеин является независимым маркером высокой смертности от сердечно-сосудистых заболеваний, сравнимым с гиперхолестеринемией и высоким артериальным давлением.
Исследования, проведенные на огромных когортах в десятки тысяч лиц, убедительно демонстрируют роль повышенного уровня гомоцистеина как независимого фактора риска развития атеросклероза, его тромботических осложнений, ишемической болезни сердца, инсультов, ишемических заболеваний сосудов нижних конечностей, венозных тромбозов, развития рестенозов артерий после ангиопластики. Более того, многими исследованиями показано и уменьшение риска соответствующих заболеваний или осложнений при применении терапии, снижающей уровень гомоцистеина.
По данным клинических исследований, увеличение концентрации гомоцистеина в плазме на 5 мкмоль/л увеличивает риск сердечно-сосудистых заболеваний и общей смертности в 1,3-1,7 раза (нормальным содержанием гомоцистеина считается концентрация 5-15 мкмоль/л у мужчин и 5-12 мкмоль/л у женщин). Общее повышение риска заболеваний за счет гипергомоцистеинемии для кардиоваскулярного риска составляет 70%, риска развития цереброваскулярных поражений - 150%, риск периферической обструкции сосудов повышается в 6 раз. Обсуждается связь гипергомоцистеинемии с развитием старческого слабоумия (болезни Альцгеймера).
Патология беременности
Микротромбообразование и нарушения микроциркуляции приводят к целому ряду акушерских осложнений. Нарушение плацентации и фетоплацентарного кровообращения ведет к репродуктивной недостаточности - невынашиванию беременности и бесплодию в результате дефектов имплантации зародыша. На более поздних стадиях беременности гипергомоцистеинемия является причиной развития хронической фетоплацентарной недостаточности и хронической внутриутробной гипоксии плода. Это приводит к рождению детей с низкой массой тела и сниженными функциональными резервами, развитию осложнений периода новорожденности.
Гипергомоцистеинемия может быть одной из причин генерализованной микроангиопатии во второй половине беременности, проявляющейся в виде позднего токсикоза (гестоза) с развитием тяжелых, часто неуправляемых состояний, иногда требующих досрочного родоразрешения. Рождение незрелого недоношенного ребенка в этих случаях сопровождается высокой детской летальностью и частыми неонатальными осложнениями.
Гомоцистеин свободно переходит через плаценту и может оказывать тератогенное и фетотоксическое действие. Было доказано, что гипергомоцистеинемия является одной из причин анэнцефалии и незаращения костномозгового канала (spina bifida).
Гипергомоцистеинемия может сопровождаться развитием вторичных аутоиммунных реакций и в настоящее время рассматривается как одна из причин антифосфолипидного синдрома. Аутоиммунные факторы могут мешать нормальному развитию беременности и после устранения высокого уровня гомоцистеина.
Диагностика гипергомоцистеинемии
Для диагностики гипергомоцистеинемии проводится определение уровня гомоцистеина в крови. Иногда используются нагрузочные пробы с метионином (определение уровня гомоцистеина натощак и после нагрузки метионином). При обнаружении высокого уровня гомоцистеина в крови необходимо проведение тестов, позволяющих обнаружить другие факторы риска развития сосудистых и акушерских осложнений.
Исследование на содержание гомоцистеина может проводиться в качестве скрининга у практически здоровых лиц для выявления группы повышенного риска развития сердечно-сосудистых заболеваний и проведения профилактических мероприятий по снижению этого риска.
Анализ на гомоцистеин полезен при сахарном диабете с его склонностью к сосудистым осложнениям.
Учитывая серьезность возможных последствий гипергомоцистеинемии при беременности, рекомендуется проверять уровень гомоцистеина всем женщинам, готовящимся к беременности. В обязательном порядке следует определять уровень гомоцистеина у пациенток с бывшими ранее акушерскими осложнениями и у женщин, у родственников которых были инсульты, инфаркты и тромбозы в возрасте до 45-50 лет.
Лечение гипергомоцистеинемии
При обнаружении гипергомоцистеинемии проводится специально подобранная терапия высокими дозами фолиевой кислоты и витаминов группы B (В6, B12, B1). Так как витаминодефицитное состояние часто связано с нарушением всасывания витаминов в желудочно-кишечном тракте, лечение, как правило, начинают с внутримышечного введения витаминов группы B. После снижения уровня гомоцистеина до нормы (5-15 мкг/мл) назначаются поддерживающие дозы витаминов per os. Такое лечение характеризуется отсутствием побочных эффектов, а кроме того, оно несравнимо более дешево, чем фармакотерапия таких факторов риска, как гипертония и гиперлипидемия.
При системных аутоиммунных заболеваниях, а также в процессе развития многих других патологических состояний происходит сенсибилизация лимфоцитов к собственным белкам организма и вырабатываются аутоантитела, направленные против антигенов компонентов клеточных ядер и цитоплазмы. Образующиеся иммунные комплексы аутоантиген-аутоантитело откладываются на базальных мембранах различных тканей и органов (кожа, почки, синовиальные, серозные оболочки, мозг и т. п.), а также снабжающих их кровью сосудов, активируя систему комплемента и вызывая воспаление и повреждение тканей. При этом повышается лизосомальная активность, выделяются медиаторы воспаления. Цитотоксическое действие оказывают фиксируемый иммунными комплексами комплемент и сенсибилизированные лимфоциты. Поражение сосудов на уровне микроциркуляторного русла лежит в основе системного повреждения соединительной ткани и паренхиматозных органов.
Исследование на антиядерные антитела проводят, если возникает подозрение на аутоиммунное заболевание или присоединение аутоиммунного компонента, играющего существенную роль в патогенезе многих нозоформ. Тест на ANA высокочувствителен (до 98%) при системной красной волчанке, однако положительные результаты могут наблюдаться при других коллагенозах и иммунокомплексных заболеваниях, а также при прочих заболеваниях, протекающих с развитием аутоиммунного компонента.
Результаты теста, полученные в разных лабораториях, могут отличаться вследствие особенностей использующихся методов. Поэтому полноценный лабораторный ответ при исследовании антинуклеарных антител обязательно должен включать описание использованного метода. Очень обширный перечень антигенов, объединенных в понятие «ядерные», требует также обязательного уточнения, антитела к каким из них могут быть выявлены используемым методом, а к каким - не могут. Иммунофлюоресцентные методы, в которых в качестве субстрата используются животные клетки, позволяют, помимо антиядерных антител, выявлять и дифференцировать также антитела к некоторым компонентам цитоплазмы, что расширяет их возможности.
Показания к назначению анализа: диагностика и дифференциальная диагностика системных заболеваний соединительной ткани (особенно СКВ), аутоиммунного гепатита, вирусного гепатита с аутоиммунным компонентом (индуцированным вирусами или лечебными вмешательствами), первичного билиарного цирроза, рассеянного склероза; выявление аутоиммунного компонента при различных заболеваниях, в патогенезе которых может играть роль аутоагрессия. Материал для исследования: сыворотка крови.
Для определения антинуклеарных антител используется методика непрямой иммунофлюоресценции с использованием в качестве субстрата клеток культивируемой линии Нер-2.
Образец (исследуемая сыворотка крови) инкубируется с субстратом, если в сыворотке присутствуют аутоантитела к ядерным или цитоплазматическим антигенам, они связываются с соответствующими компонентами субстрата с образованием комплекса антиген-антитело, который выявляется конъюгатом - антителами против иммуноглобулинов человека, меченными ФИТЦ. В результате при изучении с помощью люминесцентного микроскопа выявляется специфическая флюоресценция соответствующих ядерных или цитоплазматических структур клеток.
Использование в качестве субстрата клеток злокачественной культивируемой линии благодаря их особенностям (высокое ядерно-цитоплазматическое соотношение, крупные размеры, наличие большого количества митозов) позволяет оценить различные типы свечения, характерные для присутствия в образце крови широкого спектра антител к различным антигенам, имеющих различные клинические ассоциации.
Следует иметь в виду, что часть из определяемых типов свечения является высокоспецифичной, четко ассоциирована с определенными заболеваниями и имеет вполне определенную диагностическую значимость, в особенности при выявлении в высоких титрах; однако некоторые антитела к различным антигенам могут давать сходные типы свечения, в таких случаях может требоваться дальнейшее обследование для уточнения конкретного антигена, к которому направлены аутоантитела. С другой стороны, определенный тип антител может встречаться при нескольких нозологических формах. Существуют также антитела (они встречаются редко), реагирующие исключительно с компонентами веретенного аппарата клеток; обычно они не связаны с аутоиммунными заболеваниями, и их обнаружение расценивается как ложнопозитивный, не имеющий клинических ассоциаций результат.
Все вышеперечисленные особенности обязательно отражаются в лабораторном заключении, где, помимо указания типа свечения и соответствующего ему наиболее вероятного типа антител, даются также рекомендации по трактовке результатов в смысле возможной ассоциации с конкретными нозоформами или синдромами, а также необходимые дополнительные лабораторные исследования.
Достоинством метода иммунофлюоресценции с использованием клеток злокачественных культивируемых линий является также возможность выявления антител к некоторым антигенам цитоплазматической локализации: митохондриям, актину, лизосомам и др.
Некоторые из выявляемых антиядерных и антицитоплазматических антител с характерными для них видами свечения и клиническими ассоциациями приведены ниже:
- ядерный гомогенный тип - антитела (АТ) к ДНК (двух- и односпиральной), антитела к ДНП (дезоксинуклеопротеид - комплекс ДНК с гистонами), антитела к гистонам, антитела к другим компонентам хроматина (протамины и т.д.); клинические ассоциации - СКВ (анти-ДНК, антитела к гистонам - в высоких титрах); лекарственная волчанка, ревматоидный артрит (антитела к гистонам);
- ядерный периферический тип - АТ к двухспиральной ДНК, гистонам; клинические ассоциации - СКВ, лекарственная волчанка);
- ядерно-мембранный ламиновый тип - АТ к ламинам (фибриллярным белкам мембраны ядра); клинические ассоциации - СКВ, линейная склеродермия, ревматоидный артрит, сочетанный синдром гепатит/тромбопения/анемия;
- ядерно-мембранный кольцеобразный тип с крапчатым свечением цитоплазмы - антимитохондриальные антитела к компонентам митохондрий М2 (пируватдегидрогеназный комплекс), М3, М6; клинические ассоциации см. митохондриальный тип;
- ядерные каналы - АТ к белкам комплекса канальцев ядерной мембраны; клинические ассоциации - полимиозит;
- перихроминовый тип - АТ к перихромину; клинические ассоциации - СКВ;
- гетерогенный ядерный РНП (рибонуклеопротеин) - АТ к различным компонентам матрикса ядра; клинические ассоциации - смешанное заболевание соединительной ткани (СЗСТ);
- Sm/РНП - АТ к ядерному РНП или Sm-комплексу; клинические ассоциации - СКВ, СЗСТ (антитела к Sm); синдром Шегрена, склеродермия, ревматоидный артрит, СКВ, дискоидная волчанка, вызванная прокаинамидом (антитела к РНП);
- центромерный тип - АТ к центромере (кинетохору); клинические ассоциации - синдром CREST (кальциноз, феномен Рейно, дисфункция пищевода, склеродактилия, телеангиэктазия), склеродермия, первичный билиарный цирроз
- ядерный крапчатый тип (NSP1) - АТ против слабо охарактеризованных белков, часто сочетающиеся с антителами к актину или митохондриям; клинические ассоциации - первичный билиарный цирроз (NSP1 + митохондриальный тип), хронический активный гепатит (NSP1 + актин);
- ядрышковый гомогенный тип - АТ к нуклеолину и другим компонентам ядрышек; клинические ассоциации - сочетанный синдром полимиозита/склеродермии, склеродермия в основном с поражением почек;
- ядрышково-кластерный тип - АТ к фибриллярину (7-2-РНК), антитела к рибонуклеопротеину U3РНП; клинические ассоциации - склеродермия, обнаруживаемая в основном у молодых мужчин;
- ядрышково-крапчатый тип - АТ к Scl-70 (АТ к топоизомеразе 1); клинические ассоциации - склеродермия;
- митохондриальный (цитоплазматический) тип - АТ к М2 (пируватдегидрогеназный комплекс), М3, М6 компонентам митохондрий (антитела к М1 и М5 на клетках Hep-2 не выявляются); клинические ассоциации - первичный билиарный цирроз, лекарственная СКВ (антитела к М3, М6), хронический активный гепатит, синдром Рейнольдса, синдром Шегрена, ревматоидный артрит;
- мелкокрапчатый (цитоплазматический) тип - АТ к различным цитоплазматическим белкам, например, SPR (signal recognition particle - частица, распознающая сигнал); клинические ассоциации - миозит;
- перинуклеарный тип - АТ к антигенам Jo-7, PL1, PL7, PL12; клинические ассоциации - полимиозит, в основном в сочетании с соединительнотканным заболеванием легких; дерматомиозит;
- рибосомальный тип - АТ к антигенам рибосом; клинические ассоциации - СКВ, в основном с неврологической симптоматикой, ревматоидный артрит, синдром Шарпа;
- актин - АТ к актину (антитела к гладкой мускулатуре); клинические ассоциации - хронический активный гепатит, первичный билиарный цирроз;
- тубулин - АТ к тубулину; клинические ассоциации - алкогольный цирроз, тиреоидит Хашимото, склеродермия, синдром CREST, феномен Рейно;
- цитокератин - АТ к цитокератину; клинические ассоциации - ревматоидный артрит, склеродермия, СКВ.
ТРАКТОВКА РЕЗУЛЬТАТОВ.
У здоровых лиц моложе 60 лет следует ожидать отрицательных результатов на антитела к компонентам ядра и цитоплазмы; в низком титре (слабоположительный результат) эти антитела все же обнаруживаются у 2-3% (по некоторым данным, до 10%) практически здоровых людей, однако никогда нельзя предсказать, не разовьется ли у этих людей аутоиммунное заболевание в будущем (так, по данным некоторых авторов, антитела к ДНК начинают выявляться задолго до начала клинических проявлений СКВ, латентный период может продолжаться годами). После 60 лет частота слабоположительных результатов с возрастом постоянно растет. Клиническая значимость этих результатов остается неясной; как правило, они выявляются только в первичном (скрининговом) разведении 1:40. Исходя из этого, при выявлении положительного результата в скрининговом титре 1:40 всегда необходимо титрование, как минимум до диагностического титра 1:80. В любом случае представляется целесообразным последующее регулярное клинико-лабораторное наблюдение лиц, у которых выявлены ANA в низком титре.ОГРАНИЧЕНИЯ МЕТОДА Положительный результат предполагает наличие определенных заболеваний (см. ниже), однако, как и результат любых лабораторных исследований, может нуждаться в подтверждении или уточнении с помощью других методов, а также в установлении клинико-лабораторных корреляций.
Надо иметь в виду, что различные лекарственные препараты могут вызывать образование аутоантител (гидралазин, прокаинамид, фенитоин, карбамазепин, изониазид, хлорпромазин, пеницилламин, леводофа, пенициллин, фенилбутазон, пероральные контрацептивы, хинидин). Наиболее частыми мишенями для этих ятрогенных аутоантител являются ядерные гистоны, что приводит к развитию гомогенного или гомогенного периферического типа свечения.
ЗАБОЛЕВАНИЯ, ПРИ КОТОРЫХ ЧАЩЕ ВСЕГО ВЫЯВЛЯЮТСЯ
АНА ИЛИ АНТИЦИТОПЛАЗМАТИЧЕСКИЕ АНТИТЕЛА
- Системные поражения соединительной ткани:
- системная красная волчанка (СКВ),
- ревматоидный артрит,
- синдром Шегрена,
- склеродермия,
- дерматомиозит,
- узелковый периартериит и др.;
- Инфекции (туберкулез, инфекционный мононуклеоз, острый и особенно хронический вирусный гепатит, подострый инфекционный эндокардит, ВИЧ-инфекция и др.);
- Хронический аутоиммунный гепатит, первичный билиарный цирроз печени;
- Сахарный диабет (инсулинзависимый);
- Множественный склероз;
- Легочной фиброз;
- Системные васкулиты.
Антинуклеарные антитела также могут выявляться при острых и хронических лейкозах, приобретенной гемолитической анемии, болезни Вальденстрема, малярии, хронической почечной недостаточности, тромбоцитопениях, лимфопролиферативных заболеваниях, миастении и тимомах.
Титры антинуклеарных антител при узелковом периартериите могут достигать 1:100, при дерматомиозите - 1:500, СКВ - 1:1000 и выше. При СКВ тест на выявление антинуклеарных антител методом непрямой иммунофлюоресценции обладает высокой степенью чувствительности (до 98% по данным разных авторов), но умеренной специфичностью (78%), так как антинуклеарные антитела могут встречаться и при других, указанных выше, заболеваниях. Для сравнения, тест определения антител к нативной ДНК с помощью ИФА в диагностике СКВ обладает значительно меньшей чувствительностью - 38% (т.к. патогенетическую роль в развитии СКВ могут играть не только антитела к ДНК, но и антитела к гистонам, дезоксирибонуклеопротеину и многим другим ядерным антигенам); однако специфичность определения антител к нативной ДНК для диагноза СКВ является почти абсолютной (98%). Клиническая интерпретация этих различий в чувствительности и специфичности разных лабораторных тестов в диагностике СКВ выглядит следующим образом: отрицательный результат обнаружения антител к нативной ДНК с помощью ИФА не исключает диагноз СКВ, обнаружение же этих антител практически со 100% вероятностью подтверждает диагноз. Другая ситуация имеется в отношении АНФ: отрицательный (особенно многократный) результат обнаружения антинуклеарных антител методом непрямой иммунофлюоресценции делает диагноз СКВ (во всяком случае, активной формы) весьма сомнительным (т.к. метод обнаруживает практически все аутоантитела, встречающиеся при СКВ), обнаружение же антинуклеарных антител не всегда будет достаточным основанием для постановки диагноза СКВ, оно подтверждает наличие феномена аутоиммунитета и обычно требует для установления окончательного диагноза дальнейшей клинико-лабораторной дифференциации с учетом типа свечения, титра антител, проведения дополнительных уточняющих или подтверждающих тестов, рекомендованных лабораторией, сопоставления результатов с клинической картиной.
При СКВ корреляция между величиной титра ANA и клиническим состоянием обычно отсутствует, хотя сохранение высоких титров в течение длительного времени является неблагоприятным прогностическим признаком. Снижение уровня антител предвещает ремиссию, но иногда - летальный исход (феномен потребления антител: при нарастающем аутоиммунном повреждении тканей темп высвобождения ядерных антигенов, с которыми связываются наработанные антиядерные антитела, превышает скорость синтеза новых аутоантител).
При склеродермии частота выявления антител к ядерным антигенам составляет 60-80%, их титр обычно ниже, чем при СКВ. При ревматоидном артрите часто встречаются СКВ-подобные формы течения, поэтому довольно часто выявляются ANA. При дерматомиозите антитела к ядерным антигенам в крови встречаются в 20-60% случаев, при узелковом периартериите - в 17% (титр до 1:100), при болезни Шегрена - в 56% в сочетании с артритом и в 88% случаев - при комбинации с синдромом Гужеро-Шегрена. При дискоидной (кожной) красной волчанке антинуклеарный фактор выявляется у 50% больных.
Частота обнаружения антинуклеарных антител при ревматических
заболеваниях и у здоровых лиц (Насонова В.А. и др., 1997)
| Заболевание | Частота выявления ANA, % | Титры |
| СКВ - активная форма | 98-100 | +++ |
| Дискоидная красная волчанка | 40 | ++, +++ |
| Лекарственная волчанка | 100 | ++ |
| Системная склеродермия | 70 | ++, +++ |
| Синдром Шегрена | 60 | ++, +++ |
| Смешанное заболевание соединительной ткани | 100 | ++, +++ |
| Болезнь Рейно | 60 | ++, +++ |
| Ревматоидный артрит | 40 | +, ++ |
| Ювенильный хронический артрит | 20 | +, ++ |
| Полимиозит и дерматомиозит | 30 | + |
| Узелковый периартериит | 17 | + |
| Здоровые лица до 40 лет | 3 | + |
| Здоровые лица после 40 лет | 25 | + |
Функции. С-пептид - устойчивый фрагмент эндогенно продуцируемого проинсулина, "отрезаемый" от него при образовании инсулина. Уровень С-пептида соответствует уровню инсулина, выработанного в организме.
В молекуле проинсулина между альфа- и бета-цепями находится фрагмент, состоящий из 31 аминокислотного остатка. Это так называемый соединительный пептид или C- пептид. При синтезе молекулы инсулина в бета-клетках поджелудочной железы этот белок вырезается пептидазами и вместе с инсулином попадает в кровоток. До отщепления С-пептида инсулин не активен. Это позволяет поджелудочной железе образовывать запасы инсулина в виде про-гормона. В отличие от инсулина С-пептид биологически неактивен. С-пептид и инсулин выделяются в эквимолярных количествах, поэтому определение уровня С-пептида позволяет оценить секрецию инсулина. Надо отметить, что хотя количество образующихся при секреции в кровь молекул С-пептида и инсулина одинаково, молярная концентрация С-пептида в крови превышает примерно в 5 раз молярную концентрацию инсулина, что связано, по-видимому, с разной скоростью выведения этих веществ из кровотока. Измерение С-пептида имеет ряд преимуществ по сравнению с определением инсулина: период полураспада С-пептида в кровообращении больше, чем инсулина, поэтому уровень С-пептида - более стабильный показатель, чем концентрация инсулина. При иммунологическом анализе С-пептид не дает перекреста с инсулином, благодаря чему измерение С-пептида позволяет оценить секрецию инсулина даже на фоне приема экзогенного инсулина, а также в присутствии аутоантител к инсулину, что важно при обследовании больных с инсулинзависимым сахарным диабетом.
Уровень С-пептида изменяется в соответствии с колебаниями уровня инсулина, образующегося эндогенно. Соотношение этих показателей может изменяться на фоне заболеваний печени и почек, поскольку инсулин метаболизируется преимущественно печенью, а метаболизм и выведение С-пептида осуществляется почками. В связи с этим определение данного показателя может быть полезным для правильной интерпретации изменений содержания инсулина в крови при нарушении функции печени.
Показания к назначению анализа:
- Дифференциальная диагностика диабета 1 и 2 типов;
- Прогнозирование течения сахарного диабета;
- Бесплодие,синдром поликистозных яичников;
- Дифференциальная диагностика гипогликемических состояний;
- Подозрение на искусственную гипогликемию;
- Оценка остаточной функции бета-клеток у диабетиков на фоне инсулинотерапии;
- Выявление и контроль ремиссии (юношеский диабет);
- Диагностика инсулиномы;
- Оценка возможной патологии плода у беременных женщин, больных диабетом;
- Оценка секреции инсулина при заболеваниях печени;
- Контроль после удаления поджелудочной железы.
Проведение исследования: Забор крови выполняется натощак , материал для исследования – сыворотка.
Единицы измерения в лаборатории Компании «Новые медицинские технологии»- пмоль/л
Альтернативные единицы измерения - нг/мл. Перевод единиц: нг/мл х 331 ==> пмоль/л
Повышение уровня С-пептида:
1.Гипертрофия бета-клеток;
2.Инсулинома; Соматотропинома; APUDома;
3.Антитела к инсулину; Инсулиннезависимый сахарный диабет (ИЗСД II типа);
4.Гипогликемия при приеме пероральных сахароснижающих препаратов (производные сульфонилмочевины);
5.Почечная недостаточность;
6.Приём пищи; прием препаратов содержащих эстрогены, прогестерон, глюкокортикоиды, хлорохин, даназол, этинил-эстрадиол, пероральные контрацептивы.
Снижение уровня С-пептида:
1.Инсулинзависимый сахарный диабет (ИЗСД I типа);
2.Инсулинотерапия (нормальная реакция поджелудочной железы в ответ на введение экзогенного инсулина);
3.Алкогольная гипогликемия;
4.Состояние стресса;
5.Антитела к инсулиновым рецепторам (при инсулинорезистентном сахарном диабете II типа).
Функции:
Образуется в результате медленной неферментативной химической реакции гемоглобина А, содержащегося в эритроцитах, с глюкозой крови. Скорость и объем этой реакции зависят от среднего уровня глюкозы на протяжении жизни эритроцита. Существует несколько вариантов образующихся продуктов - гликированных гемоглобинов: НbA1a, HbA1b, HbA1c, Последняя форма количественно преобладает и дает более тесную корреляцию со степенью выраженности сахарного диабета. Гликированный (гликозилированный) гемоглобин отражает гипергликемию, имевшую место на протяжении периода жизни эритроцитов (до 120 сут). Эритроциты, циркулирующие в крови, имеют разный возраст, поэтому для усредненной характеристики уровня глюкозы ориентируются на полупериод жизни эритроцитов - 60 суток. Таким образом, уровень гликированного гемоглобина показывает, какой была концентрация глюкозы в предшествующие 4-8 недель и является показателем компенсации углеводного обмена на протяжении этого периода. Нормализация уровня гликированного гемоглобина в крови происходит на 4-6 неделе после достижения нормального уровня глюкозы. У больных сахарным диабетом уровень этого соединения может быть повышен в 2-3 раза. В соответствии с рекомендациями ВОЗ этот тест признан оптимальным и необходимым для контроля сахарного диабета. Больным сахарным диабетом рекомендуется проводить исследование уровня гликированного гемоглобина не менее одного 1 раза в квартал. Значения могут различаться между лабораториями в зависимости от применяемого аналитического метода, поэтому контроль в динамике лучше проводить в одной лаборатории или тем же методом.
При контроле за лечением диабета рекомендуется поддерживать уровень гликированного гемоглобина менее 7% и пересматривать терапию при содержании гликированного гемоглобина более 8% (указанные значения применимы только для сертифицированных методов с референсными пределами 4-6%). Клинические исследования с использованием сертифицированных методов показывают, что рост доли гликированного гемоглобина на 1% связан с изменением, в среднем, уровне глюкозы плазмы примерно на 2 ммоль/л Гликированный гемоглобин используется как показатель риска развития осложнений диабета. Снижение доли гликированного гемоглобина на 1/10 связано с примерно 45% снижением риска прогрессии диабетической ретинопатии.
Показания к назначению анализа:
1.Диагностика и скрининг сахарного диабета;
2.Долговременный мониторинг течения и контроля за лечением больных сахарным диабетом;
3.Определение уровня компенсации сахарного диабета;
4.Дополнение к глюкозотолерантному тесту при диагностике преддиабета, вялотекущего диабета;
5.Обследование беременных женщин (скрытый диабет).
Подготовка к исследованию:
Уровень гликированного гемоглобина не зависит от времени суток, физических нагрузок, приема пищи, назначенных лекарств, эмоционального состояния пациента. Состояния, вызывающие укорочение среднего "возраста" эритроцитов (после острой кровопотери, при гемолитической анемии), могут ложно занижать результат теста.
Материал для исследования: цельная кровь с антикоагулянтом (ЭДТА).
Сроки исполнения: несколько дней
Единицы измерения и коэффициенты пересчета:
Единицы измерения в лаборатории «Новые медицинские технологии» - % от общего количества гемоглобина
Повышение уровня HbA1С:
- Сахарный диабет и другие состояния с нарушенной толерантностью к глюкозе;
- Определение уровня компенсации (зарубежная литература):
5.5-8% - хорошо компенсированный сахарный диабет;
8-10 % - достаточно хорошо компенсированный сахарный диабет;
10-12% - частично компенсированный сахарный диабет;
>12% - некомпенсированный сахарный диабет;
- Дефицит железа;
- Спленэктомия.
Ложное повышение может быть обусловлено высокой концентрацией фетального гемоглобина (HbF).
Снижение уровня HbA1С:
1.Гипогликемия;
2.Гемолитическая анемия, кровотечения, переливание крови.
Физиологическая роль, структура и локализация
Эозинофильный катионный белок (ЭКБ) - один из протеинов, входящих в состав цитоплазматических гранул эозинофилов. Эозинофилы - клетки крови, появляющиеся в большом количестве в очагах воспаления и при определенных паразитарных инфекциях. В зрелом состоянии эти лейкоциты в основном находятся в тканях, но около 1% популяции эозинофилов циркулирует в периферической крови. Свое воздействие на окружающие ткани эозинофилы реализуют через четыре основных протеина. Протеины гранул эозинофилов, которые убивают паразитов и их личинки, могут оказывать повреждающие действие на ткани при бронхиальной астме и других воспалительных заболеваниях. Активность эозинофилов тесно взаимосвязана с возникновением и обострением бронхиальной астмы, атопического дерматита, ринитов, аллергических заболеваний глаз, аллергических заболеваний среднего уха, паразитарных и бактериальных инфекций, аутоиммунных заболеваний, синдрома хронической усталости.
Из четырех основных протеинов гранул эозинофилов именно ЕСР (эозинофильный катионный протеин) является наиболее значимым показателем для мониторинга активности многих воспалительных заболеваний. ЭКБ характеризуется высоким содержанием аргинина, связываясь, как и остальные «основные» белки эозинофилов, кислыми красителями (эозин). Белок имеет уникальную последовательность концевых аминокислот, что позволяет его идентифицировать с помощью моноклональных антител. Абсолютно специфичен для эозинофилов. Обладает рибонуклеазной активностью. Стимулирует секрецию слизи в бронхах, тормозит пролиферацию Т-клеток, связывает и нейтрализует гепарин, подавляет коагуляцию, является мощным цитотоксином для шистосом, вызывая разрыв мембран паразитов и их фрагментацию. ЭКБ оказывает токсическое воздействие на нервные клетки, на некоторые эпителиальные клетки и клетки миокарда.
Диагностическая информация
ЭКБ попадает в кровоток при дегрануляции эозинофилов и отражает степень выраженности этого процесса, возрастая в крови больных с аллергическими заболеваниями (бронхиальная астма, аллергический ринит, атопический дерматит) и при гельминтозах. Повышение концентрации ЭКБ в плазме и некоторых других жидкостях организма отражает участие и активность эозинофилов в воспалительной реакции.
Уровень ЭКБ коррелирует с клиническими симптомами астмы, показателями функции дыхания (спирометрия), реакцией дыхательных путей на ингаляторы, позволяя оценить степень воспалительных процессов в дыхательных путях. У больных с сезонным течением бронхиальной астмы ЭКБ изменялся согласно изменяющейся активности заболевания в течение всего года. Уровни ЭКБ оказываются выше нормы как при IgE-зависимых, так и IgE-независимых аллергических состояниях. Измерение уровня ЭКБ лишено несоответствий, присущих субъективной оценке астмы.
Мониторирование уровня ЭКБ в крови позволяет оценить тяжесть течения астмы, особенно у детей, прогнозировать развитие астматического приступа, контролировать эффективность лечения воспалительного компонента у больных астмой, подобрать оптимальную дозу лекарственных препаратов.
Определение ЭКБ имеет значение в оценке тяжести течения ряда кожных аллергических заболеваний (например, атопического дерматита), а его концентрация коррелирует с выраженностью ряда признаков заболевания (лихенификация, потеря сна, эритема, образование папул и т.п.). В сыворотке больных с атопическим синдромом уровень ЭКБ был выше, чем у больных без признаков атопии, даже в тех случаях, когда уровень эозинофилов крови оставался нормальным. По концентрации ЭКБ в сыворотке можно судить о степени тяжести некоторых кожных болезней. Нейротоксичность ЭКБ может усугублять интенсивность зуда при некоторых кожных заболеваниях. У пациентов с папулезной эритематозной сыпью отмечаются повышенные уровни ЭКБ, нормализующиеся после ее исчезновения. Была показана взаимосвязь между повышением уровня ЭКБ и выраженностью клинических проявлений кожных аллергических заболеваний, и его нормализация в период клинической ремиссии или выздоровления. Клиническая значимость уровня ЭКБ может превышать важность определения общего IgЕ, поскольку уровень IgЕ в ряде случаев не коррелирует с выраженностью клинической симптоматики.
Референсные пределы и дискриминантный уровень
Средние значения у здоровых людей значительно колеблются, с медианой 10-11 нг/мл. Дискриминантный уровень - 24 нг/мл (DPC). Вышеуказанные показатели зависят от вида используемых тест-систем.
Таким образом, уровень ЭКБ является объективным критерием участия эозинофилов в возникновении клинических симптомов гиперчувствительности и является достоверным критерием не только диагностики заболеваний, но и эффективности проводимого лечения.
Ингибин — пептид, состоящий из двух субъединиц. Существуют две формы гормона - ингибин А и ингибин В. У женщин гормон синтезируется в фолликулах, а у мужчин – в семенных канальцах яичек (клетки Сертоли). Во время беременности основным продуцирующим органом ингибина А является плацента. Если ингибин А обнаруживают в основном у женщин (функция его у мужчин неизвестна), то главной формой циркулирующего в крови ингибина у мужчин является ингибин В. В клинической практике используются только диагностические наборы для выявления в сыворотке крови димерных форм ингибина А и В, так как только димерные формы ингибина являются биологически активными. Ингибин селективно ингибирует освобождение ФСГ из передней доли гипофиза и обладает паракринным действием в гонадах.
Уровень ингибина А остается низким в начале фолликулярной фазы, затем начинает повышаться к концу фолликулиновой фазы и достигает максимума в середине лютеиновой фазы. Уровни эстрадиола и ингибина А очень сильно коррелируют друг с другом в течение фолликулярной фазы (с –14 дня по 2 день менструального цикла). Приблизительно через неделю с момента образования желтого тела начинается его обратное развитие, при этом секретируется меньше эстрадиола, прогестерона и ингибина А. Падение уровня ингибина А устраняет его блокирующий эффект на гипофиз и секрецию ФСГ. В ответ на повышение уровня ФСГ окончательно формируется пул антральных фолликулов, из которых в дальнейшем разовьётся доминантный фолликул.
У женщин по мере старения отмечается снижение концентрации ингибинов А и В. Когда число созревающих фолликулов в яичниках становится ниже определенного порога, наблюдается снижение концентрации ингибина, что ведет к повышению уровня ФСГ.
За последние два года в процедурах ЭКО для оценки овариального резерва стал использоваться новый маркер – ингибин В. Овариальный резерв – способность яичников отвечать на стимуляцию гонадотропинами достаточным числом зрелых яйцеклеток, пригодных для оплодотворения в процедуре ЭКО. Концентрация ингибина В, измеренная на 3-й день цикла, прогнозирует ответ яичников на стимуляцию гонадотропинами в циклах ЭКО. У женщин со сниженным уровнем ингибина В необходимо увеличивать дозу экзогенного ХГЧ в цикле стимуляции суперовуляции, меньше число получаемых ооцитов, меньше число переносимых эмбрионов на цикл, меньше частота наступления беременности и в 11 раз выше частота преждевременных выкидышей по сравнению с женщинами, у которых ингибин В был в норме. Измерение ингибина В позволяет напрямую более точно оценить овариальную функцию, чем ФСГ.
Ингибин В является маркером функции клеток Сертоли и экзокринной тестикулярной функции (состояния сперматогенеза). Ингибин В является прямым маркером и сперматогенеза. Его концентрация у здоровых мужчин обычно меньше 480 пг/мл, и, в отличие от женщин, она постоянна (не носит циклических колебаний). Однако, в патологических ситуациях (бесплодие), уровень ингибина В может быть снижен. Было показано, что у 100% обследованных с содержанием сперматозоидов в сперме менее 20 млн/мл концентрация ингибина В в сыворотке была ниже 80,0 пг/мл, а ФСГ – выше 10 Ед/л (см. рисунок). У мужчин, прошедших лечение по поводу варикоцеле, существенно увеличивался уровень ингибина B в сыворотке крови, тогда как содержание ФСГ, ЛГ и тестостерона за все время наблюдения не менялось. Это доказывает, что ингибин В может использоваться для мониторинга лечения пациентов с варикоцеле. Ингибин B точно предсказывает успех процедуры TESE при азооспермии. Его низкая концентрация указывает на неадекватное производство спермы и может исключать хирургическую процедуру (TESE) для получения жизнеспособной спермы.
Ингибин В является основным показателем EFORT-теста(Exogenous FSH Ovarian Reserve Test) - тест на функциональный резерв яичников).
Тест на функциональный резерв яичников EFORT
(Exogenous FSH Ovarian Reserve Test)
Суть теста: Измерение физиологического ответа яичников на введение фолликулостимулирующего гормона. Быстрый и точный тест функционального резерва яичников.
Может проводиться аналогичный EFORT-тесту тест на тестикулярный резерв для мужчин .
Показания:
- неудачные попытки ЭКО, недостаточный ответ на стимуляцию;
- бесплодие неясного генеза;
- укорочение менструального цикла;
- проблемы оплодотворения;
- мажущие выделения в конце цикла;
- предоперационная подготовка (при операциях на матке и яичниках);
- пограничные или повышенные значения ФСГ;
- пременопауза.
Определение снижения резерва яичников позволяет определить:
- Показания к ЭКО
- Необходимость ускорить проведения ЭКО
- Показания к ЭКО с донорской яйцеклеткой
- Риск развития раннего климакса (соответственно, развития остеопороза, сердечно-сосудистых осложнений)
- Объем оперативного вмешательства на яичниках
Тест существует в двух вариантах:
Простой EFORT-тест
Расширенный EFORT-тест
Как сдается анализ:
Пациентка два раза сдает кровь на ингибин В. Первый раз – в день цикла, назначенный врачом (обычно – 3 день цикла). В этот же принято назначать сдачу и других гормонов: ЛГ, ФСГ. После забора крови на анализ делается инъекция Гонала-Ф. Второй раз пациентка сдает кровь через 24 часа. Таким образом, мы получаем две цифры ингибина В – до стимуляции Гоналом-Ф и после. Конкретные значения двух показателей позволяют оценить функциональный резерв яичников.
| Простой EFORT-тест | Расширенный EFORT-тест |
Первый день сдачи теста:
| Первый день сдачи теста:
|
Второй день:
| Второй день:
|
При планировании IVF (ЭКО) рекомендуется определение уровня AMH/MIS в рамках EFFORT-теста (вместе с ингибином B до и после стимуляции Гоналом-Ф, соответственно на 3 и 4 сутки менструального цикла). При этом уровень ингибина B повышается, а уровень AMH/MIS снижается.
Антимюллеровский гормон (ингибирующее вещество Мюллера,
AMH/MIS, Anti-Mullerian Hormone/Mullerian-Inhibitory Substance)
ВХОДИТ В РАСШИРЕННЫЙ EFORT-ТЕСТ – ТЕСТ НА ФУНКЦИОНАЛЬНЫЙ РЕЗЕРВ ЯИЧНИКОВ
Быстрый и точный тест функционального резерва яичников.
- неудачные попытки ЭКО, недостаточный ответ на стимуляцию
- бесплодие неясного генеза
- проблемы оплодотворения
- пограничные или повышенные значения ФСГ
Ингибирующее вещество Мюллера – MIS (известное также как анти-мюллеров гормон – AMH), является димерным гликопротеином, принадлежащим к семейству трансформирующих факторов роста. В процессе эмбрионального развития он секретируется клетками Cертоли и отвечает за регрессию Мюллеровых протоков у мужчин. До наступления половой зрелости АМН продуцируется яичками, а затем его уровень постепенно снижается до остаточных пост-пубертатных значений. Нарушение функции антимюллерова гормона вызывает у мужчин сохранение дериватов мюллеровых протоков. Это состояние клинически проявляется крипторхизмом, паховыми грыжами и нарушением репродуктивной функции и названо синдромом персистенции мюллеровых протоков (СПМП). СПМП - редкая форма ложного мужского гермафродитизма. Несмотря на то, что у пациентов с СПМП не нарушена дифференцировка яичек, у них часто отмечают бесплодие. Бесплодие у пациентов с СПМП может быть вследствие поздно устраненного оперативными методами крипторхизма, приводящего к атрофии семенных канальцев и вторичной андрогенной недостаточности. Возникновение СПМП может быть обусловлено мутациями как гена AMH, так и гена рецептора AMH (AMHRII). У женщин от момента рождения и до наступления менопаузы АМН продуцируется в незначительных количествах гранулезными клетками яичников, причем, наиболее высокие его уровни наблюдаются в опухолевых гранулезных клетках.
Определение АМН используется:
- для выявления преждевременного или замедленного полового созревания,
- в установлении пола в сомнительных случаях,
- при постановкe диагноза крипторхизма и анорхизма,
- в оценке мужской половой функции в любом возрасте,
- в исследовании овариального резерва и пременопаузальных изменений у женщин,
- в диагностике и контроле гранулезоклеточного рака яичника.
При планировании IVF (ЭКО) рекомендуется определение уровня AMH/MIS в рамках EFFORT-теста (вместе с ингибином B до и после стимуляции Гоналом-Ф, соответственно на 3 и 4 сутки менструального цикла). При этом уровень ингибина B повышается, а уровень AMH/MIS снижается.
Снижение базального уровня AMH/MIS < 0,8 сопровождается низкой вероятностью наступления беременности в результате IVF(ЭКО).
У женщин AMH/MIS вырабатывается клетками гранулезы фолликулов. В протоколах IVF(ЭКО) у женщин старшего репродуктивного возраста успех наступления беременности тем выше, чем выше уровень AMH/MIS. При синдроме поликистозных яичников уровень AMH/MIS выше, чем у нормально овулирующих женщин.
| Пол | Возраст или стадия полового созревания | Концентрация MIS/AMH Среднее ± SD нг/мл |
Муж.
Жен. | <15 дней | 32 ± 8,3 |
| 15 дней – 1 год | 65,1 ± 13,0 | |
| 1 – 4 года | 69,9 ± 9,2 | |
| 4 – 7 лет | 61,3 ± 8,4 | |
| 7 – 9 лет | 47,0 ± 6,6 | |
| Стадия 1 | 34,9 ± 3,7 | |
| Стадия 2 | 22,2 ± 3,5 | |
| Стадия 3 | 11 ± 3,9 | |
| Стадия 4 | 6,7 ± 1,9 | |
| Взрослые | 4,2 ± 0,6 | |
| 0 – 9 лет | 3,5 ± 1,8 (всегда < 10) | |
| Репродуктивный возраст(15 – 41 год) | 2,1 – 7,3 | |
| Снижение функционального резерва яичников | <1,1 |
Ревматоидный артрит (РА) - наиболее распространенное аутоиммунное заболевание, поражающее около 1% населения всего мира. Это заболевание характеризуется воспалением синовиальной оболочки, которое распространяется симметрично от малых к большим суставам. Начальные симптомы заболевания включают болезненное опухание суставов на пальцах с потерей гибкости в суставах по утрам. Ранняя диагностика и безотлагательное начало подходящей терапии необходимы для того, чтобы держать заболевание под контролем.
Наиболее широко используемым серологическим тестом при подозрении на РА до настоящего времени было определение ревматоидного фактора (РФ). Это антитела (преимущественно класса IgM), которые реагируют с гаммаглобулинами и обнаруживаются у 60-80% пациентов с РА. РФ - чувствительные, но не очень специфичные маркеры РА, так как они также обнаруживаются у здоровых людей, у пациентов с инфекционными заболеваниями или при других аутоиммунных заболеваниях (системная красная волчанка, синдром Шегрена, склеродерма и др.). У 40-60% пациентов с РА в сыворотке крови также обнаруживаются аутоантитела к эпидермальному филаггрину (РА кератин, антиперинуклеарный фактор). Филаггрин - это белок эпидермиса, который связывает между собой кератиновые филаменты. Антитела к филаггрину обнаруживаются с помощью иммунофлуоресценции: антигенный субстрат пищевода крысы окрашивается в роговом слое (РА кератин) с люминальной стороны; антиперинуклеарные факторы (APF) видны в цитоплазматических тельцах (включениях) эпителиальных клеток слизистой оболочки рта человека.
Недавно было показано, что редкая аминокислота цитруллин, которая входит в состав филаггрина, является важным компонентом антигенного эпитопа. В качестве полезной альтернативы непрямым имунофлюоресцентным методам предлагаются иммуноферментные тесты, в которых используют синтетические пептиды, содержащие щитруллин как антиген-мишень. Сравнительный анализ этих методов показывает, что чувствительность иммуноферментного определения может быть увеличена с 49% до 68% при использовании в качестве субстрата циклического пептида (вместо линейных пептидов). Антитела к циклическому цитруллин-содержащему пептиду (CCP) являются новым и высокоспецифичным маркером при РА.
Антитела к CCP относятся преимущественно к классу IgG, и их специфичность при РА составляет около 97%. Они обнаруживаются на очень ранних стадиях заболевания и имеют высокое предсказательное значение; у пациентов с антителами к CCP развивается существенно более выраженное повреждение суставов, обнаруживаемое радиологическими методами, по сравнению с пациентами, у которых антитела к CCP
отсутствуют. Антитела к CCP обладают более высокой специфичностью по сравнению с РФ (анти-CCP: 97%, РФ: 63%) при той же чувствительности (анти-CCP: 80%, РФ: 79%). Их можно обнаружить на ранних стадиях заболевания у 79% пациентов.
Референтный интервал:
| cut-off | перцентиль |
| 2,6 Е/мл | 95% |
| 3,3 Е/мл | 98% |
| 4,2 Е/мл | 99% |
Средняя концентрация анти-CCP в крови здоровых доноров составила 1,2 0,8 Е/мл, а диапазон составил 0,2-8,0 Е/мл. При уровне cut-off, равном 5 Е/мл, 0,5% доноров крови были положительными по анти-CCP.
При анализе результатов исследований проб 419 пациентов с РА и 1144 контрольных проб (744 сыворотки с другими заболеваниями - псориатический артрит, другие артропатии, СКВ, синдром Шегрена, склеродермия, аутоиммунный тиреоидит, грануломатоз Вегенера, положительные по антителам к парвовирусу, вирусные гепатиты, положительные по ВИЧ, и 400 сывороток здоровых доноров крови) были определены следующие показатели чувствительности и специфичности:
Суммарная чувствительность и специфичность этого теста в случае заболевания ревматоидным артритом составила 78,5% и 98,2% соответственно.
| cut-off | чувствительность | специфичность |
| 2,6 Е/мл | 95,0% | 81,4% |
| 4,2 Е/мл |
98,0%
| 79,0% |
| 8,0 Е/мл | 99,0% | 75,4% |
В случае положительного результата в контрольной панели, нельзя исключать ни того, что пациенты страдают ревматоидным артритом помимо вышеперечисленных заболеваний, ни того, что у них ранняя стадия заболевания РА, когда клинические признаки отсутствуют. В различных исследованиях было показано, что у большинства пациентов, положительных по CCP без характерных для РА симптомов, ревматоидный артрит развивается в течение нескольких лет после серологического исследования.
Особенности забора материала на исследование: сыворотка на антитела к циклическому цитруллиновому пептиду не допускает замораживания, поэтому длительные сроки хранения материала невозможны. Учитывая относительно высокую стоимость анализа и необходимость набора для постановки 8-9 проб, производится предварительная запись пациентов, при накоплении нужного количества пациентов они вызываются для забора крови, анализ производится в течение 2-3 дней.





Часто мы задумываемся над своим здоровьем только тогда, когда начинаем чувствовать какое-то недомогание. Однако всем известно, что болезнь легче предупредить, чем лечить. Сохранению крепкого здоровья может способствовать только здоровый образ жизни: рациональный режим труда, отдыха и питания, отказ от вредных привычек, физическая активность. Одним из элементов здорового образа жизни является полный отказ от табака.




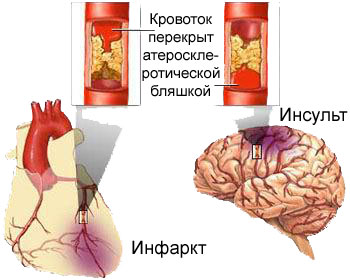
Атеросклероз - это хроническое заболевание, при котором стенки артерий уплотняются и теряют эластичность, что ведет к сужению их просвета, а значит и к затруднению тока крови. Жертвами атеросклероза обычно становятся лица среднего и пожилого возраста. Однако атеросклеротические изменения обнаруживаются, в ряде случаев, у детей и даже у новорожденных.



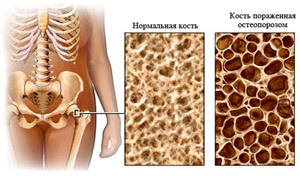
На сегодняшний день остеопороз – одна из важнейших проблем российского здравоохранения. По статистике, после 55 лет каждая вторая женщина и каждый пятый мужчина имеют переломы, возникающие в результате остеопороза. Общепризнанно, что остеопороз становится причиной 90% всех переломов шейки бедра и позвонков у пожилых людей, особенно это касается переломов, возникших спонтанно или от незначительной травмы. От 13 до 37 % пациентов с переломом шейки бедра умирают в течение года после перелома.

